![]()
von Manfred D.Kuno
Einleitung
Folgende anamnestische Befunde begegnen uns bei Patienten mit malignen Geschwulstkrankheiten sehr häufig:
Diese Befunde korrelieren auch mit aktuellen Erkenntnissen z.B. zur Durchblutungssituation innerhalb des Tumorgebietes: einerseits führt die Ausschüttung von Angiogenesishormon zu einer massiven Neubildung versorgender Kapillaren, andererseits führen diese chaotischen "Neoangiogenesen" zu Strömungsumkehr und arterio-venösen Shuntbildungen. Die Folge sind Nekrosebildungen und Gärungsstoffwechsel innerhalb des Tumors. Hinzu kommt das Problem, daß aufgrund einer hohen Teilungsrate in den Tumor-Randbereichen innerhalb des Tumors ein extremer Gewebedruck entsteht, der wiederum Nekrosebildung und Gärungsstoffwechsel verstärkt.
Ein Ausdruck hiervon ist eine tiefgreifende toxische Störung der Verwertung von Sauerstoff und den daraus resultierenden geweblichen Folgen, v.a. im Bereich der Matrix und der Mitochondrien. Diese Umstände wurden ja bereits in den 20er Jahren von Warburg und Jung, und später von Seeger detailliert beforscht.
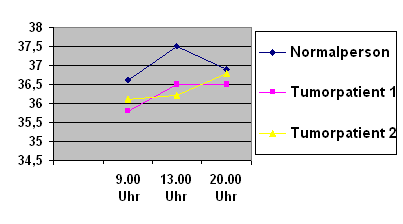
Abbildung 1:
Tages-Temperaturkurven von Tumorpatienten gegenüber Normalperson:
Das Gesamt-Temperaturplateau von Tumorpatienten liegt insgesamt niedriger, die Tagesrhythmik erscheint gestört.

Sauerstoff und Oxidation
Es ist einige Millionen Jahre her, daß sich durch die Entwicklung von Sauerstoff in der Erdathmosphäre ein dramatischer entwicklungsgeschichtlicher Schritt vollzog: die Entwicklung von Leben unter den Gestzmäßigkeiten von Sauerstoff- und Wasserstoffverwertung zur Gewinnung von Körperenergie und Körperwärme. "Verwertung von Sauerstoff" ist der Schlüsselbegriff, der Voraussetzung höherentwickelter Lebewesen bis hin zu den Säugetieren und dem Menschen ist. Während vor der Anwesenheit von Sauerstoff auf unserem Planten, also unter anaeroben Verhältnissen niederes Leben in Form von Plankton und Algen möglich war, leitete Sauerstoff die Besiedelung der Erde mit höher entwickelten Vielzellern ein.
Oxidation ist Basis für Leben und Garant für die Produktion von Körperenergie und -wärme, aber auch Quelle etlicher gefährlicher Reaktionsketten, die u.a. zur Auslösung, zumindest aber zur Förderung von Krebserkrankungen führen kann.
Unser Organismus besitzt für diesen Vorgang in den meisten Körperzellen eine Vielzahl von symbiontisch lebenden intrazellulären Mikroorganellen: die Mitochondrien. Es handelt sich hierbei um kleinste, im Zytoplasma aller Körperzellen lebende, reduplikationsfähige Organellen mit eigener DNA (mDNA), die sich vermutlich im Laufe der Entwicklung aus Bakterien zu intrazellulären Symbionten entwickelten. Innerhalb der Mitochondrien, genauer gesagt innerhalb ihrer (Christae-)Membranen und Tubuli spielt sich in jeder Sekunde faszinierende biochemische "Feuerwerke" ab: die oxidative Phosphorylierung der Atmungskette, die Fettsäureoxidation und der Zitronensäurezyklus, Systeme der Gewinnung von Körperenergie und Erhaltung von Körperwärme.
Über Nahrungskette und Atemluft gelangen Wasserstoffionen und Sauerstoffatome auf dem Blutweg und durch die Passage der schützenden Matrix in unsere Zellen. Hier erfolgt innerhalb der Mitochondrienmembranen eine von Wasserstoff und Sauerstoff, und unter Mitwirkung des Cytochromsystems (v.a. der Cytochromoxidase) getragene "Zündung" der energieliefernden Reaktionskaskade (Atemkette). Ein beständiger und genau regulierter Wechsel von Wasserstoffabgabe und Sauerstoffaufnahme gewährleistet die intra- und extrazelluläre Homöostase. Dieses "Fließgleichgewicht" ist die Grundlage für das funktionieren der energiegewinnenden Reaktionswege in den Systemen der oxidativen Phosphorylierung und des Zitronensäurezyklus. Es produziert u.a. Adenosintriphosphat (ATP), ein biochemisches Substrat für Körperenergie und Körperwärme. Da dieser Vorgang der Oxidation gesteuert werden muß, um eine Balance im Redox- und pH-System, im Mineralstoffaustausch (v.a. Ka-Na-Austausch) und insgesamt in der Homöostase des intra- und extrazellulären Milieus zu erhalten, exitiert hier ein außerordentlich sensibles System der Regulation: das Redoxsystem. Die Kraft mit der dieser Elektronenaustausch stattfindet, wird als Redoxpotential bezeichnet, und diese Kraft ist durch verschiedene auf dem Markt angebotene Medizintechniken meßbar (Systeme nach Vincent und Kapf-Lautenschläger).
In der Regel werden zur diagnostischen Einschätzung der Redoxaktivität folgende Parameter gemessen:
Eine Einschätzung ist jedoch prinzipiell auch durch weniger aufwendige Techniken, z.B. durch Messung des Ro-Wertes im Supravitalblut mittels einer Glaselektrode.
Oxidation und Freie Radikale
Durch die innerhalb der Mitochondrien ablaufenden Reaktionskaskaden entstehen ständig auch sehr aggressive chemisch-aktive Verbindungen, sog. Freie Radikale. Diese sind seit langem als potentielle Kofaktoren beim Krebsgeschehen im Mittelpunkt des Forschungsinteresses. Auch bei anderen schweren chronischen Erkrankungen wird ihre zumindest mitverursachende Rolle diskutiert. Sie entstehen als Stoffwechselmetaboliten bei der Oxidation und sind für Schädigungen sowohl der Mitochiondrien selbst, aber auch anderer Zellorganellen, der Zell-DNA und der extrazellulären Matrix verantwortlich. (1,2,3,4)
Freie Radikale können zu Punktmutationen an der Zellkern- und Mitochondrien-DNA führen. Tritt dies in einem gesunden Organismus ein, kommt es zum Eingreifen intrazellulärer Reparaturmechanismen. Versagen diese Mechanismen, kommt es im besten Fall zum Untergang der betroffenen Zelle (= apoptotischer Zelltod), im schlechtesten Fall zur Entdifferenzierung und folgenden Tumorbildung. Freie Radikale können die energieliefernden Mitochondrien und ihren sensiblen Metabolismus (ATP-Synthese) stören, einige Untersuchungen lassen vermuten, daß Mitochondrien in der Folge ihre Wirtszellen verlassen, um ein günstiges Überlebensmilieu (z.B. das Blut) zu suchen. Die Folge ist hiernach die Mangelversorgung der Zelle und nachfolgend ebenfalls der Zelltod oder die Entartung. (5-14)
Untersuchungen an Krebspatienten oder anderen Menschen mit schweren toxischen Belastungen zeigen, daß sich im frisch entnommenen (Supravital-) Blut massenhaft amöboid bewegliche kleinste Partikel ansammeln (Übersicht bei 15), die solchen ausgewanderten Mitochondrien entsprechen könnten. Die intra- und extrazellulären Folgen sind fatal: von der biochemischen Irritation der Mitochondrien über deren vermutliche Auswanderung, der Verschhiebung des Redoxpotentials (Ro) und des Säure-Basen-Haushaltes (pH) kommt es zur intensiven Störung des geweblichen Mileus (der Homöostase).
Zerstörung der extrazellulären Matrix
Die Folge dieser Prozesse ist eine zunehmende Auflösung der aus polymeren Zuckern, Kollagen und Elastin aufgebauten Matrix. Dies wiederum ermöglicht das Eindringen von toxischen und/oder mikrobiellen Bestandteilen aus dem Blut in die Zelle, zudem kommt es zur Störung der lokal-geweblichen Immunregulation, die im gesunden durch Gewebemastzellen, Granuloyten und Fibrozyten gewährleistet ist. Die darauf folgende Störung auch der systemischen zellulären und humoralen Immunregulation ist eine Frage der Zeit.
Ricker, Speranski, Reckeweg, Pischinger und zuletzt Heine lieferten in ihren (aufeinander aufbauenden) Matrixforschungen Grundeinblicke in die zentrale Bedeutung dieses vernachlässigten Biosystems. (16)
Wie wir aus dem Erfahrungsschatz der Ganzheitsmedizin, verbunden mit den neuen Erkenntnissen der Neuro-Endokrino-Immunologie wissen, ist die zunehmende Schädigung lokal-geweblicher Kompartimente immer von einer systemischen Störung gefolgt. Grund ist eine im Menschen bestehende systemische Vernetzung der großen Systeme ZNS-Edokrinium-Immunsystem über Neurotransmitter, Hormone und Zytokine (s.Abb.). Die Matrix als "Informationspool" aller dieser Systeme steht (neben den Mitochondrien) im Mittelpunkt der Schädigung durch Freie Radikale. Ihre Zerstörung durch Strukturauflösung stellt ein weitgehend unterschätztes kanzerogenes Risiko dar, und leider wird die Behandlung von Matrix und Redoxsystem (nicht nur in der Onkologie) noch immer weitgehend vernachlässigt.
Das Antioxidanzien-System
Unser Organismus besitzt ein eigenes und beständig aktives System, um die Radikalenbildung zu neutralisieren. Hierzu gehören essentielle Vitamine wie Vitamin E und C, Mineralstoffe wie Magnesium, Spurenelemente wie Selen und Zink, sowie das körpereigene Tripeptid Glutathion. Eine ausgewogene Ernährung sollte grundsätzlich Garant für ein gut funktionierendes antioxidatives System sein, welches für eine zuverlässige Neutralisierung der Radikalenbildung sorgt. Die Zunahme von Nahrungsmittel-Denaturierungen durch Zusatz von z.B. Konservierungsmitteln, der Konsum von Genußmitteln (v.a. Alkohol und Nikotin) sowie der maßgebliche Einfluß von Umweltnoxen in Trinkwasser, Atemluft und Nahrungsmitteln sorgt allerdings dafür, daß unser Redoxsystem einem beständigen Stress ausgesetzt ist. Die Folgen sind sinkende Spiegel von Zink, Selen, Magnesium und Glutathion, die durch die Nahrungszufuhr nicht mehr ausgeglichen werden können.
Die antioxidative Kapazität unseres Organismus befindet sich praktisch in einer chronischen Erschöpfung, die Zahl der Freien Radikalbildungen nimmt beständig zu. Diese Problemstellung ist in vielen einschlägigen Darstellungen der orthomolekularen Literatur beschrieben.(26,27,28,29)
Glutathion im Mittelpunkt des Interesses
Glutathion ist ein körpereigenes kleines "Mini-Eiweiß" (Tripeptid), welches in jeder Körperzelle vorhanden ist und an einer Reihe von Entgiftungs-, Transport- und Biosynthesefunktionen beteiligt ist. In der Ernährung wird es v.a. über Fleisch (Innereien) zugeführt. Es tritt im Organismus in der Regel in einem bestimmten Verhältnis von reduzierter und oxidierter Form auf, wobei nur die reduzierte Variante des Glutathion die oben beschriebenen Aktivitäten entfaltet. Reduziertes Glutathion (G-SH) ist eine außerordentlich flüchtige und reaktionsfreudige Substanz, die z.B. durch Sauerstoff oder Magensäure chemisch verändert (und somit therapeutisch unwirksam) wird, indem es zur oxidierten Stufe umgewandelt wird. Dies war in der Vergangenheit auch immer wieder der Grund für Schwierigkeiten in der medikamentösen Aufbereitung und Stabilisierung.
Normalerweise besteht in unserem Körper ein Gleichgewicht zwischen reduziertem und oxidiertem Glutathion. Enzyme des Glutathion-Systems spielen eine wichtige Rolle in diesem Gleichgewicht und haben ihrerseits wichtige Aufgaben: die Glutathion-Peroxidase beispielsweise eliminiert aggressive Peroxide, die Glutathion-Reduktase hat einen Einfluß auf Elektronen-Transferaktionen.
Nimmt die Zahl Freier Radikaler im Organismus zu, kommt es zum Absinken des Anteils reduzierten Glutathions. Kann dem vom Organismus nicht begegnet werden (z.B. mit Hilfe der Aminosäure Cystein oder des Vitamin E), so kommt es zu einem Mangel an reduziertem Glutathion, und damit zu einer ungehinderten Aktivität der aggressiven Radikale. (1)
Medizinische Aspekte des Glutathion
Seit einigen Jahren steht Glutathion im Mittelpunkt einiger Forschungsinteressen. Neben der rein antioxidativen Wirksamkeit, die Glutathion beispielsweise zu einem der ältesten Strahlenschutzmittel werden ließ (Strahlenwirkung basiert auf dem Prinzip der Oxidation!), kommt in den letzten Jahren der hochdosierten Verabreichung reduzierten Glutathions eine zunehmende Bedeutung in der Krebsmedizin zu. (17,18,19)
Dabei spielen sowohl die präventive (Apoptoseinduktion)(20,21), die stark entgiftende (Detoxifikation, v.a. gegenüber Schwermetallen)(19), die immunmodulierende (T-Zell-Stimulation)(18,22), wie auch und vor allem die zytotoxische Wirkung auf Tumorzellen (23,24,25)eine Rolle.
Während reduziertes Glutathion in niedriger Dosierung vor allem seine entgiftende, antioxidative und Strahlenschutzwirkung zu entfalten scheint, weist es offenbar in in hoher Dosierung tumorhemmende und immunmodulierende Einflüsse auf.. Internationale Forschungen und klinische Anwendungen zeigen, daß red.Glutathion zur Stimulation von T- und nk-Zellen führt, Tumorzellen in die Apoptose überführt, und in der klinischen Anwendung Tumorremissionen unterschiedlicher Tumorarten bewirkt. (17-25)
Neue Wege in der Glutathiontherapie
Entscheidend für den therapeutischen Effekt ist die Stabilität des verabreichten Glutathions. Optimal wäre die intravenöse Apllikationsform, d.h. die Verabreichung reduzierten Glutathions direkt in die Blutbahn. Diese Therapieform steht uns heute nicht zur Verfügung. In der oralen Therapie bestand lange Zeit das Problem, das Glutathion in der Magen-Darm-Passage vor denaturierenden Einflüssen (z.B. der Magensäure) zu schützen, und in hoher reduzierter Form zur Resorption zu bringen. Ein neues galenisches Prinzip eröffnet hier offenbar neue Möglichkeiten: das reduzierte Glutathion wird entweder unter hohem mechanischen Druck, oder aber in flüssiger Form in einer Art "molekularem Tresor" fixiert. Diese Verbindung des Wirkstoffes (red.Glutathion) mit einem stoffwechselneutralen und ungiftigen Hilfsstoff (b -Cyclodextrin) soll eine hohe Resorptionsquote des Glutathion im unteren Duodenum gewährleisten. Ein solches System wurde kürzlich unter dem Namen Red-Ox® von der Schleswiger MENTOP Pharma entwickelt und verspricht einen neuen interessanten Ansatz in der komplementären Onkologie. Eine Tablette enthält 100mg red.Glutathion, sowie 100mg b -Cyclodextrin in einem speziellen "Arznei-compound".
Wir haben in unserer Praxis mit dem breiten Einsatz dieser Glutathiontherapie begonnen, wobei wir in der Dosierungsfrage wie folgt unterscheiden: in der antioxidativen und krebspräventiven Therapie verordnen wir 2x2 Tbl/Tag, bei Rauchern (vermindertes Redoxpotential!) 2x3 Tbl./Tag, im Rahmen der Onkotherapie 2x5 Tbl./Tag.
Erste Anwendungen deuten darauf hin, daß v.a. Patienten mit Störungen der Leberfunktion von dieser Behandlung profitieren. So konnten wir bei Patienten mit Leberszirrhose und/oder Steatosis hepatis, aber auch bei Patienten mit Lebermetastasen z.T. dramatische Besserungen pathologisch erhöhter Transaminasen beobachten, die auch nach Dosisreduktion oder Absetzen des Glutathion anhielten. Offenbar ist die detoxifizierende Wirkung auf das Leberparenchym, die nicht nur im onkologischen Themenrahmen von Interesse ist, beachtlich. Dem entsprechen auch Hinweise aus Untersuchungen von Matsuno, Dalhoff und Kawano, die unter hochdosierter Applikation von red. Glutathion Rückbildungen von Lebertumoren beschreiben (9,23,24).
Wir werden zu geg. Zeit über unsere Eindrücke mit dieser innovativen Therapievariante berichten. Wir möchten an dieser Stelle alle Kolleginnen und Kollegen darum bitten, uns ihre praktischen Erfahrungen in der Anwendung reduzierten Glutathions in geeigneter galenischer Form (wie oben beschrieben) mitzuteilen, um eine Art bundesweite Anwendungsbeobachtung zu dokumentieren.
Literaturhinweise:
Krebses, S.51ff, Medizinalpol.Verl.Hilchenbach 1960
a High Glycolytic Rate? Med.Hypothesis 32(2), 151-155, Barcelona 1990
Korrespondenzanschrift:
Hp Ralf Kloppenborg, Hp
Manfred Kuno
Peter-Strasser-Weg 35
12101 Berlin
Tel. 785 71 51
Fax. 785 82 12